
열역학(熱力學, Thermodynamics)은 열(heat)과 일(work)을 다루는 물리학의 분야로 공학 분야에서 많이 응용되고 있습니다. 인류문명은 불을 사용하면서 시작되었기 때문에, 열역학은 주로 열을 중심으로 한 에너지의 변환과 흐름에 관련된 원리를 설명합니다. 열역학의 원리는 열역학 제1법칙과 제2법칙으로 요약되는데, 그 원리를 지금부터 간단하게 살펴보겠습니다.
열역학 제 1법칙, 에너지 보존
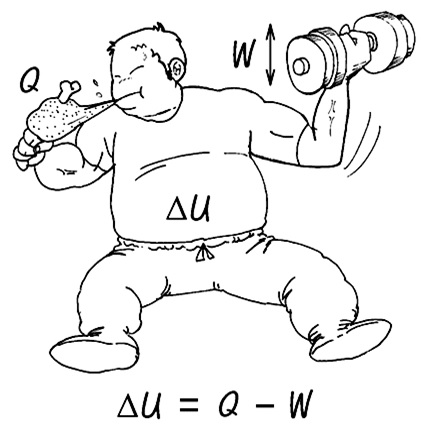
열역학 제1법칙은 에너지의 보존 법칙으로, 에너지는 스스로 소멸되거나 생성되지 않고 들어온 만큼 나간다는 단순하고 고지식한 법칙입니다. 만약 나가는 것에 비해 들어오는 것이 많으면 그 차이만큼 내부에너지는 증가하고, 반대로 나가는 것이 많으면 내부에너지는 감소합니다. 즉 공급된 열에너지(Q)와 외부로 행한 일에너지(W)의 차이는 내부에너지의 변화(ΔU)로 나타납니다.

아래 수식에서 보듯이 열(Q)과 일(W)은 서로 더하거나 뺄 수 있는데, 서로의 형태는 달라도 모두 에너지라는 같은 물리량을 의미하므로, ‘열’과 ‘일’은 등가(等價)라는 사실을 설명합니다.
▲ 열역학 제 1법칙
예를들어, 내가 벌어들인 수입(Q)에서 지출한 비용(W)을 빼면 내가 취득한 재산 증가분(ΔU)이 됩니다. 여기서 돈이나 금 또는 기타 재화 등은 형태에 관계없이 모두 동일한 금전적 가치를 갖는다고 봅니다. 인체에 대해서 이 법칙을 적용해 보면, 내가 먹은 음식의 열량을 Q라 하고 행한 일을 W라 할 때, 그 차이는 내 뱃살 ΔU로 축적됩니다. 인체 열역학 제1법칙은 밥과 일 그리고 살의 보존성과 등가성을 설명합니다. 많이 먹고 일을 적게 하면 살이 찌고, 적게 먹고 많이 움직이면 살을 뺄 수 있다는 평범한 진리에 도달하는 것이지요.

열역학 제 2법칙, 에너지 방향성
열역학 제2법칙은 엔트로피(entropy) 증가의 법칙으로 열이 흘러가는 방향, 즉 온도가 높은 곳에서 낮은 곳으로 흐르는 사실을 설명합니다. 설령 온도가 낮은 곳에서 높은 곳으로 열이 흐르더라도 에너지는 보존될지언정, 자발적으로 일어나진 않습니다. 엔트로피(S)는 물질의 열적 상태를 나타내는 물리량으로, 그 변화량은 Δ엔트로피(S)=열량(Q)/온도(T)로 계산됩니다.
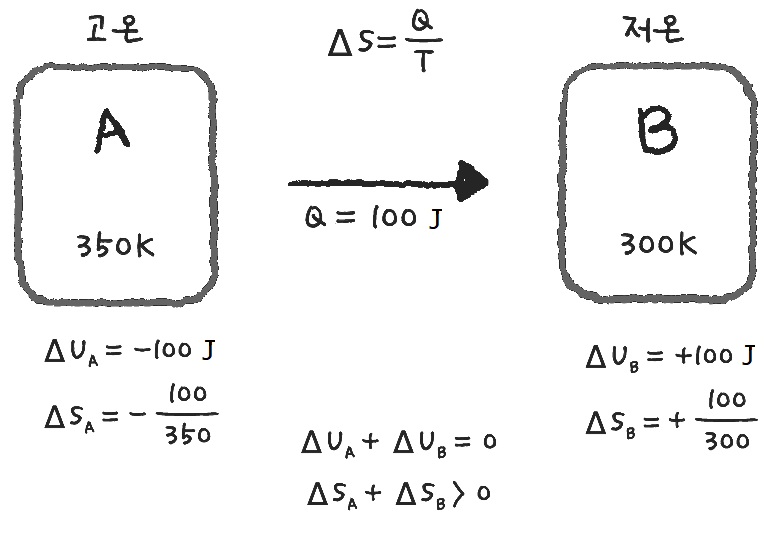
▲ 열역학 제 2법칙, 엔트로피 (출처: 공대생도 잘 모르는 재미있는 공학이야기, 플루토)
위의 그림을 보면, 뜨거운 물체는 열을 빼앗기면서 엔트로피가 감소하고, 차가운 물체는 열을 얻으면서 엔트로피가 증가하게 됩니다. 이때 각각의 엔트로피 변화량은 절대온도의 역수, 1/T에 비례하기 때문에 저온 물체 B의 엔트로피 증가량(+100/300)이 고온 물체 A의 엔트로피 감소량(-100/350)보다 큽니다. 따라서 두 물체의 엔트로피 변화량을 합친 값은 플러스가 되어 열역학 제2법칙을 만족시킵니다.
통계 열역학에서는 엔트로피를 ‘경우의 수’로 설명합니다. 엔트로피는 경우의 수 W에 상용로그를 취한 값으로 정의되며, 이때 비례상수 k는 볼츠만 상수입니다. 경우의 수가 1일 때 엔트로피가 제로이고, 경우의 수가 많아질수록 엔트로피가 커집니다. 즉 열역학적으로 엔트로피가 증가한다는 것은 확률이 높아진다는 것을 의미합니다.
여러 개의 동전이 모두 앞으로 엎어져 있을 경우의 수는 1이지만, 앞뒤가 뒤섞여 놓일 경우의 수는 많습니다. 마찬가지로 수많은 기체 분자들이 한 곳에 몰려 있을 확률보다 골고루 흩어져 있을 확률이 높습니다. 그렇기 때문에 방귀를 끼면 엔트로피를 증가시키기 위해 가스가 한군데 머물러있지 않고, 공기와 섞이면서 널리 확산되는 것입니다.
 ▲ 포텐셜(Potential)
▲ 포텐셜(Potential)
엔트로피는 ‘무질서도’를 의미하며, 잘 정돈되어 있던 것들이 시간이 지나면서 점차 어질러지는 것을 말합니다. 여기서 무질서하다는 것은 질서가 없다기보다는, 무작위적으로 상태가 균일화되는 것을 의미합니다. 또한 온도 차이나 농도의 불균형처럼 어떤 변화를 유발시키는 포텐셜이 사라지면서, 더 이상 자발적인 변화가 일어나지 않게 되어 ‘일을 할 수 없게 됨’, ‘쓸모가 없어짐’으로 설명하기도 합니다.
이는 궁극적으로 모든 것이 균일화되면, 더 이상 어떠한 변화도 일어나지 않는 열역학적 죽음에 도달하였다고 할 수 있습니다.
열역학에 의한 인류의 발전

18세기 이전에는 열을 플로지스톤(phlogiston)이라는 하나의 물질로 생각한 적이 있습니다. 이는 당시까지 믿었던 아리스토텔레스의 4원소설, 모든 물질은 물, 불, 흙, 공기로 이루어졌다는 이론에 따른 것입니다. 열역학의 역사는 이러한 플라지스톤 학설이 깨지면서 시작되었다고 볼 수 있습니다. 이후 열역학에 관련된 원리들이 과학적으로 밝혀지고 공학적으로 응용되면서 열기관(engine)이라는 인류역사에 한 획을 긋는 발명품이 만들어졌습니다.

엔진은 화석연료로 얻은 열에너지를 이용하여 일에너지를 만들어내는 기계로, 사이클(cycle)을 이루며 반복적으로 작동합니다. 최초의 엔진인 증기기관은 1차 산업혁명을 이끌며, 인류의 삶을 크게 바꿔 놓았습니다. 지금까지도 디젤엔진, 가스터빈, 스털링엔진 등 다양한 열기관들과, 열펌프와 냉동기계 등 열역학 사이클을 이용한 기계들이 우리 생활 속에서 널리 이용되고 있지요.
지금까지 열역학에 대한 이야기를 나누었습니다.
열역학의 에너지 보존 법칙과 엔트로피 개념은 기계공학이나 화학공학뿐 아니라 정보통신공학, 사회경제학 등 다양한 이론의 개념적 근거를 제시하는 만큼, 그 기본 개념을 알아두면 여러 학문을 이해하는데 도움이 될 수 있습니다. 공학의 기본 이론을 설명하는 '쉽게 알아보는 공학 이야기' 다음 편도 기대해주세요.

